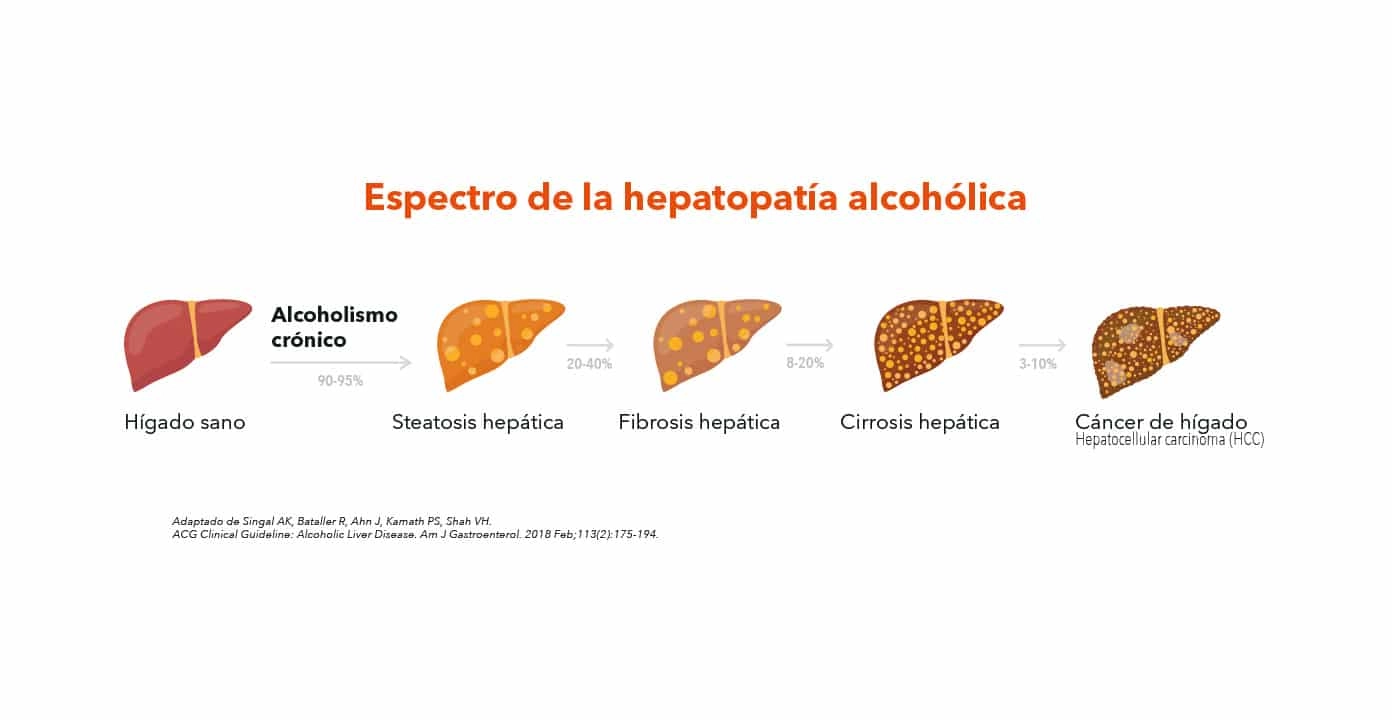
Enfermedad hepática debida a alcoholismo
El alcohol es responsable de 3 millones de muertes al año (5,3 % de la mortalidad mundial)*11. En todo el mundo, más del 50 % de la mortalidad relacionada con cirrosis es atribuible al alcohol.7 Cada vez que el hígado filtra alcohol, parte de las células hepáticas mueren. Beber en exceso durante muchos años puede reducir su capacidad de regeneración con daños irreversibles.

¿Qué es la hepatopatía alcohólica?
La hepatopatía alcohólica abarca un amplio espectro clínico-histológico que comprende esteatosis hepática alcohólica, hepatitis alcohólica (HA), esteatohepatitis alcohólica (EHA) y cirrosis con sus complicaciones asociadas.
El diagnóstico de la hepatopatía alcohólica requiere la documentación del consumo excesivo crónico de alcohol y la exclusión de otras causas de hepatopatía.
Esteatohepatitis alcohólica (fibrosis)
La hepatopatía alcohólica tiene una progresión con un patrón bien conocido. Comienza con la hepatopatía alcohólica y algunas personas pueden presentar inflamación hepática, degeneración vacuolar y lesión de los hepatocitos, que se define histológicamente como esteatohepatitis alcohólica (EHA), que evoluciona con lentitud a cirrosis y sus complicaciones asociadas, como el carcinoma hepatocelular (CHC).
Hepatitis alcohólica (inflamación)
Además de la esteatohepatitis alcohólica (EHA), la persona también puede presentar hepatitis alcohólica (HA), que es una inflamación hepática aguda asociada a una morbimortalidad importante.
¿Quién tiene riesgo de padecer hepatopatía alcohólica?
La enfermedad está causada por un consumo crónico de alcohol que supera una determinada cantidad. Se ha demostrado que el consumo crónico de alcohol de entre 12 y 24 g al día aumenta considerablemente el riesgo de cirrosis en comparación con el hecho de no beber22.
¿Por qué es importante el cribado de la hepatopatía alcohólica entre los pacientes de riesgo?
La mayoría de los pacientes se diagnostican en estadios avanzados y los datos sobre la prevalencia y el perfil de los pacientes con enfermedad incipiente son limitados. En consecuencia, la identificación de la hepatopatía alcohólica en atención primaria durante las primeras fases es clave para promover la conducta, cambiar y revertir la evolución de la enfermedad.
El daño hepático causado por enfermedades hepáticas crónicas a menudo puede revertirse mediante un diagnóstico y una intervención tempranos7.
Nuestras soluciones para la salud hepática, FibroScan® y Scores by echosens, permiten un tratamiento integral de la salud hepática.
Tenemos pruebas fehacientes de la utilidad de la elastografía de transición mediante FibroScan® en la evaluación de la fibrosis en la hepatopatía relacionada con el alcohol.
* Incluye muertes relacionadas con enfermedades asociadas al alcohol en distintos órganos, así como lesiones relacionadas con accidentes de tráfico y violencia.
Las referencias están disponibles en nuestra bibliografía.